药物筛选与临床前药效评价多采用细胞和动物模型。然而,这些模型并不能完全反映人体在疾病过程中的病理变化及其对药物的反应性,更无法再现肿瘤发生发展的全过程以及临床上患者肿瘤组织的复杂情况。
肿瘤类器官是利用手术切除、活检等方式获得患者体内肿瘤组织,利用机械研磨法、酶消化法等方式进行处理,对获得的肿瘤细胞进行三维培养建立的体外模型。相较于传统的细胞与动物模型,肿瘤类器官具有诸多优点,其中最重要的特征在于可以更好模拟患者肿瘤组织真实环境。
4月25日,发表在Nature Cancer上的一篇论文中,由西班牙巴塞罗那生物医学研究院(IRB Barcelona)结直肠癌实验室负责人、癌症网络生物医学研究中心(CIBERONC)组长Eduard Batlle博士领导的国际科学家团队,与荷兰Merus N.V. 公司共同公布了首个基于肿瘤干细胞类器官模型筛选的临床候选药物MCLA-158的作用机制与临床前数据,该研究为药物研发中基于类器官筛选抗体药物奠定了基础。
类器官的药物发现前景
肿瘤具有极强的异质性,目前更提倡对肿瘤患者实施精准医疗。类器官最重要的应用之一在于个性化精准医疗,帮助医生为患者选择最适宜的药物。此项研究拓宽了类器官的应用场景,将类器官用于药物开发与筛选。
为了开发和表征MCLA-158,HUB Organoids(由类器官创始人Hans Clevers创建)的研究人员建立了一个大型生物样本库,其中包括了来自结直肠癌、结直肠癌肝转移以及正常组织的类器官。来自Ocello BV的实验团队采用肿瘤患者的类器官生物样本库从数百个抗体中筛选出最有潜力的MCLA-158。
在MCLA-158的研发早期采用来自患者的肿瘤类器官,有助于筛选出对大多数患者、甚至是携带特定突变患者有效的抗体药物。而来自正常组织的类器官则可以识别药物潜在的不良反应,在研发早期及时停止对安全性较差药物的资源投入。
MCLA-158:EGFR x LGR5双特异性抗体
MCLA-158是一种双特异性抗体,与表达富含亮氨酸重复序列G蛋白偶联受体5(LGR5)和表皮生长因子受体(EGFR)的肿瘤干细胞结合。LGR5是肿瘤干细胞表面标志物,促进肿瘤扩增,而EGFR可以促进肿瘤细胞失控增殖。
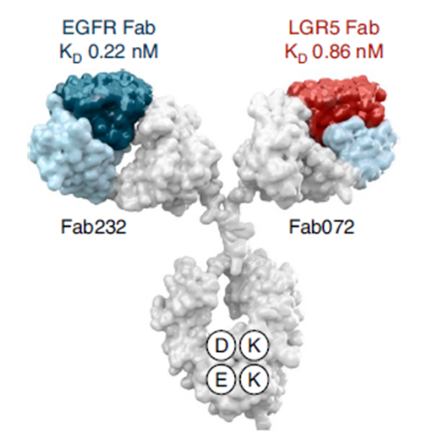
MCLA-158结构(来源:Nature Cancer)
Batlle博士的实验室因其在结直肠癌干细胞的鉴定和表征方面的工作而享誉全球,他不仅主持了MCLA-158的开发工作,而且领导了其作用机制的表征工作。
临床前实验模型中,MCLA-158可与细胞结合后触发LGR5+肿瘤干细胞的EGFR降解,具有两种不同的作用机制。第一种途径是启动阻止肿瘤起始细胞生长与存活的信号通路(肿瘤起始细胞在实体瘤中长期存在,可能导致肿瘤的复发与转移)。第二种途径是招募并增强免疫效应细胞对肿瘤起始细胞的直接杀伤作用。健康干细胞对机体组织修复意义重大,而这种抗体不会干扰健康干细胞的功能。
研究表明,MCLA-158在类器官模型上可以有效抑制结直肠癌细胞生长与转移;在几项临床前研究中,MCLA-158对头颈部肿瘤、食道癌和胃癌都有良好的抑制作用。
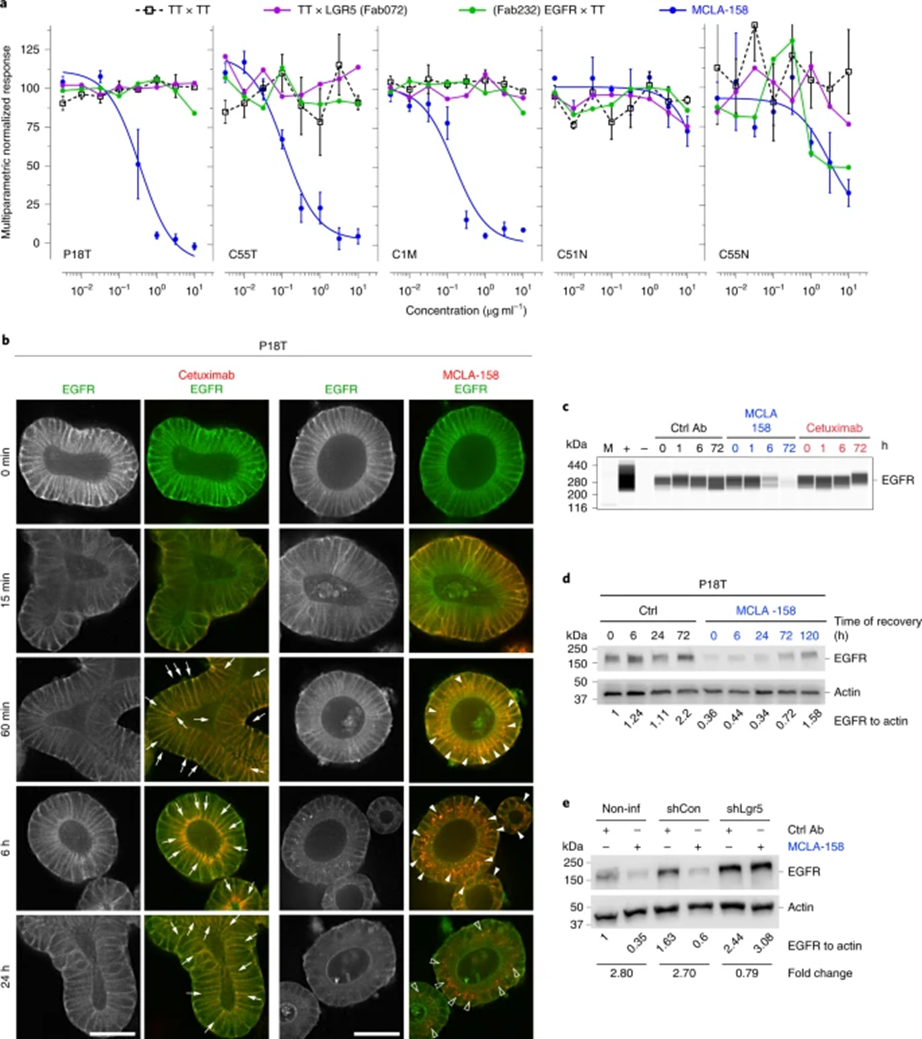
MCLA-158介导EGFR降解(来源:Nature Cancer)
事实上,2021年10月,Merus N. V.曾报告MCLA-158的初步临床研究数据,汇总了MCLA-158单药治疗晚期头颈部鳞癌(HNSCC)临床I期剂量爬坡试验中的安全性、耐受性和有效性结果。7例可评估患者肿瘤体积全部缩小,3例患者达到部分缓解,其中1例患者在2021年8月数据截止日期后获得完全缓解。
目前,MCLA-158正在全球进行一项多中心、开放的临床I期剂量爬坡试验,评估该药物在结直肠癌的早期证据,预期将于2022年下半年公布其试验数据。