作者:阿拉蕾
RAS家族(包括KRAS,NRAS,HRAS)致癌突变在肿瘤中较为常见。针对KRAS的研究较多,其在肺癌、胰腺癌和结直肠癌中的突变率分别约为30%、90%和40%,与预后不良有关。以肺癌为例,85%的KRAS突变为G12突变。其中,G12C、G12V、G12D突变分别约占46%、23%、17%。KRAS G12C是药物研发的热门靶点。
2021年8月,Cancer Discovery的封面研究就与KRAS G12C抑制剂治疗后的获得性耐药有关。说实话,小编并没有完全理解封面图的含义,官网的图片注释仅介绍了研究的主要结果。个人推测,图片可能显示了治疗后的多克隆耐药改变,期待读者们能为小编解惑。
虽然KRAS G12C是研发的热门靶点,KRAS抑制剂的开发却充满挑战,曾有“不可成药”的魔咒,正式介绍这篇封面研究之前,先简单回顾一下这段历程。
KRAS抑制剂的研发之路
为何有“不可成药”之说呢?首先,KRAS蛋白在“激活、GTP结合”(“ON”状态)和“失活、GDP结合”(“OFF”状态)之间循环转换,激活态KRAS才是调节下游信号通路,促进肿瘤细胞增殖、存活和转移的活性状态。然而,KRAS对GTP有非常高的亲和力,给开发有效的竞争性抑制剂带来困难。
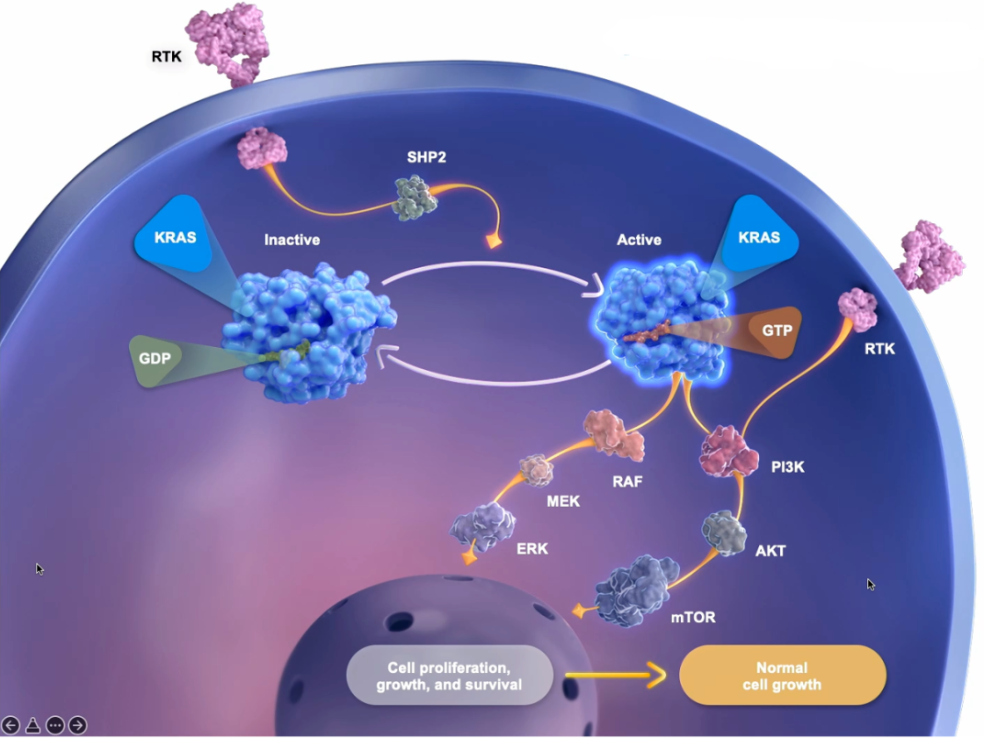
图片来自AACR
其次,通常在药物研发时,科学家们会观察蛋白质的形态,有“深口袋”结构的蛋白分子会比较理想,这样药物可以进入其中,与多个关键性位点结合,从而发挥药效。但是,KRAS蛋白体积小且表面光滑,缺乏足够大的“口袋”来容纳抑制剂。
尽管有上述的困难,sotorasib(AMG510)的获批,开创了靶向KRAS的新时代。目前具有代表性的KRAS抑制剂:sotorasib(AMG510)和adagrasib(MRTX849),均属于KRAS G12C-GDP抑制剂,即结合在KRAS-G12C的失活(OFF)状态,从而抑制下游的信号传导,也就是采取了一种“迂回”策略。
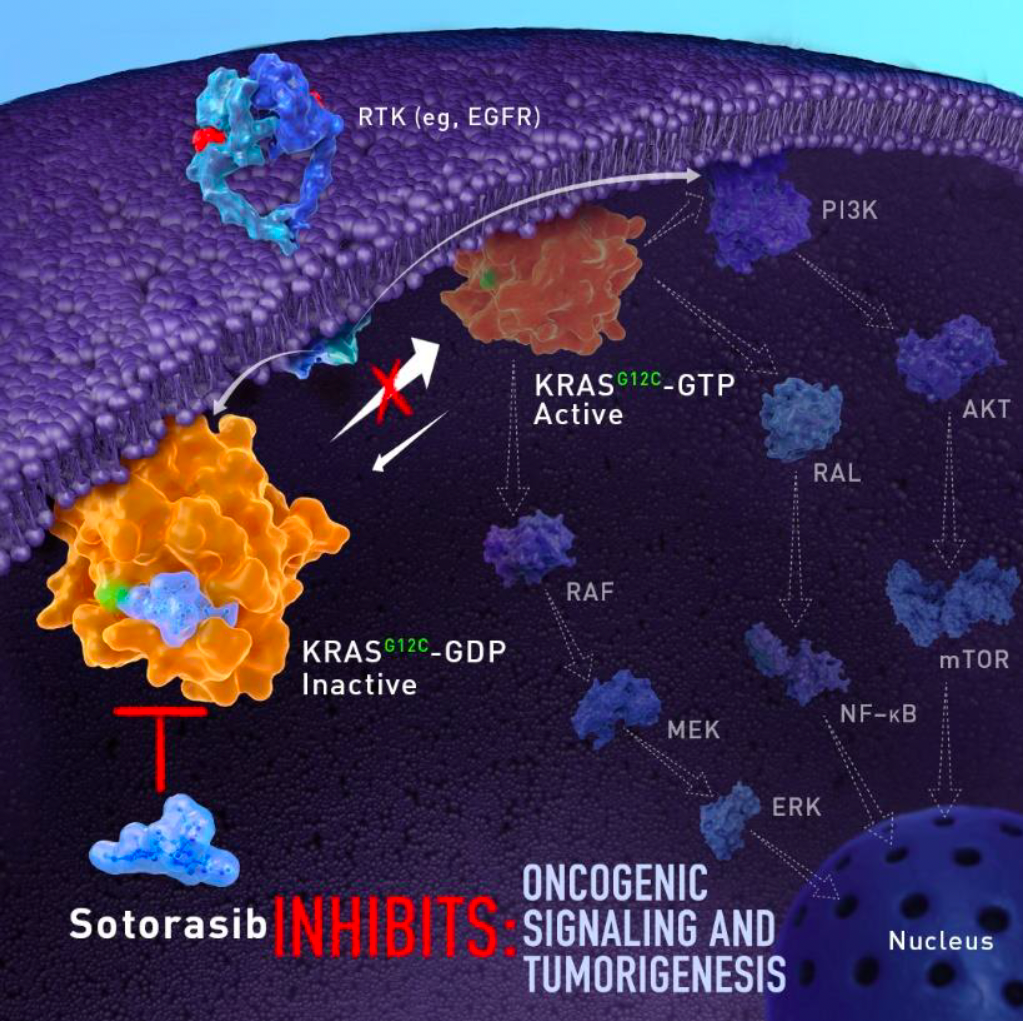
图片来自安进官网
目前,KRAS抑制剂在非小细胞肺癌(NSCLC)中显示出有意义的疗效,sotorasib和adagrasib的ORR分别为37%和45%,疾病控制率(DCR)分别为81%和96%。但是,现有的KRAS抑制剂,临床疗效常不能持久,这也是临床上面临的难点。
获得性耐药机制的探索
回到顶刊封面的这篇文章,研究者报告了一个病例。一名67岁的KRAS G12C突变晚期NSCLC患者,接受adagrasib(MRTX849)治疗,肿瘤体积减少32%。但是,在治疗后~4个月,疾病出现进展(下图),5.5个月时停止adagrasib治疗。为了充分了解获得性耐药机制,科学家们使用NGS和微滴式数字PCR(ddPCR)来评估cfDNA(cell-free DNA)。
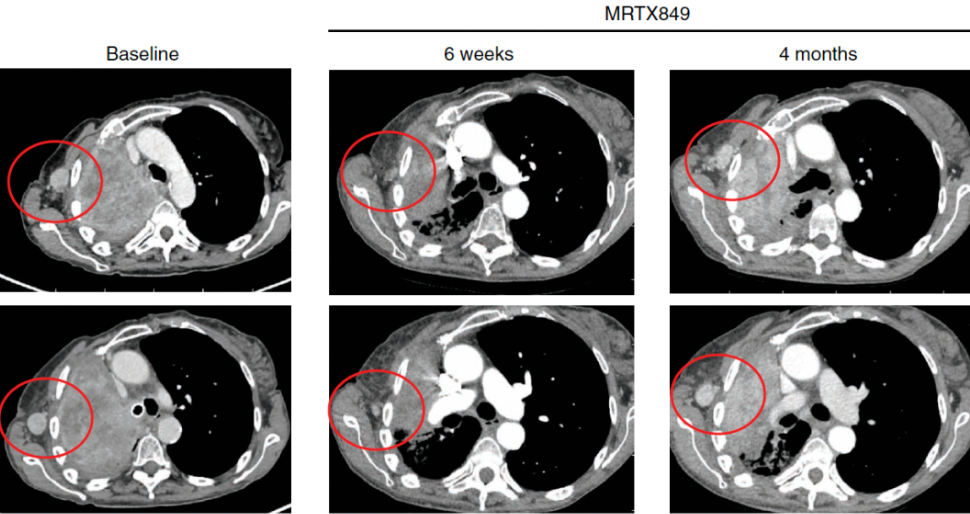
结果显示,治疗前在肿瘤组织和cfDNA中检测到的KRAS G12C和TP53 F338fs突变再次在cfDNA中检测到,疾病进展后的cfDNA中还出现了10种可影响RAS-MAPK通路的突变,分别是:
1、3个激活的NRAS突变:包括NRAS Q61L、NRAS Q61K和NRAS Q61R,它们能以不依赖KRAS的方式活化RAS信号通路。
2、BRAF V600E突变:在MRTX849存在的情况下,它仍可维持KRAS G12C下游MAPK的信号传导。
3、3个MAP2K1(注:编码MEK1蛋白)突变:包括MAP2K1 K57N、MAP2K1 Q56P和MAP2K1 E102-I103del,它们与MAPK通路抑制剂(例如:BRAF抑制剂)的耐药有关。
4、3个KRAS突变:既往研究已经证实,KRAS G12C抑制剂对KRAS G13D和KRAS G12V突变无效。值得注意的是,发现了第3个KRAS突变——KRAS Y96D,这是一种既往未知的新突变。科学家们进行了结构建模,显示Y96残基与AMG510或MRTX849之间的氢键缺失(下图),影响了抑制剂的结合位点,提示其在获得性耐药中具有新的作用机制。
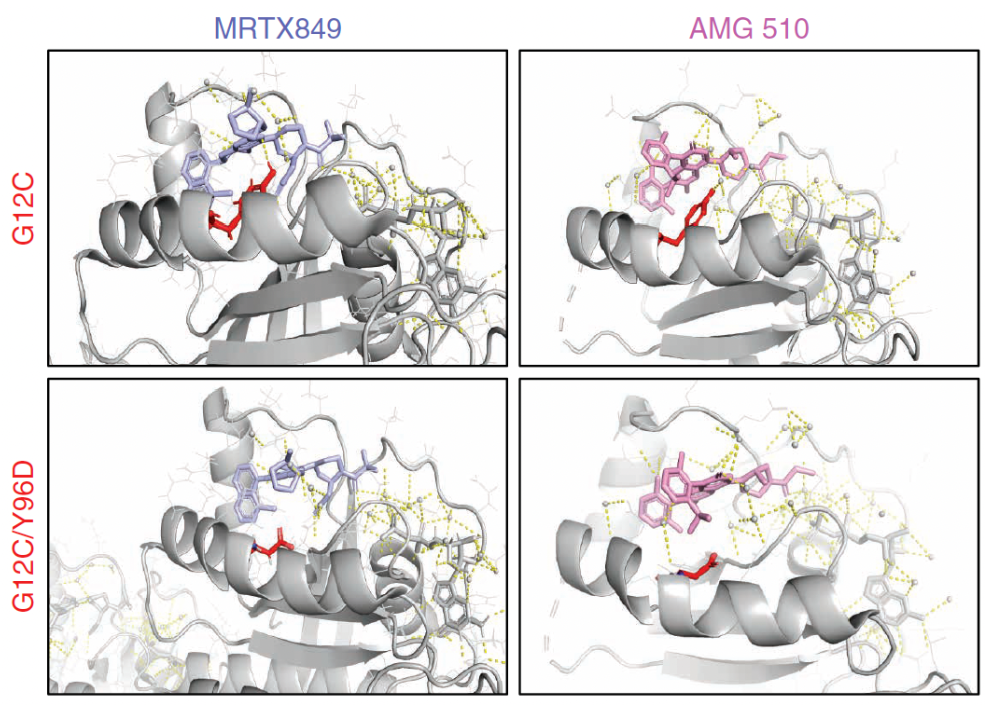
科学家们又进行了细胞试验,表达KRAS G12C/Y96D细胞对KRAS G12C抑制剂表现出显着的耐药性,MRTX849和AMG510的IC50变化>100倍。此外,即使在高浓度MRTX849下,KRAS G12C/Y96D细胞的RAS-MAPK信号通路活性持续存在。


